「CAR-T細胞の研究を始めたけれど、そもそもどうやって作られるのだろうか?」
「作製法や課題について、まず全体像を理解したい」
そう思っている方もいるのではないでしょうか?
CAR-T細胞は、T細胞を体外で遺伝子改変して作製される細胞医薬品です。
その作製プロセスは、細胞の採取・分離、遺伝子導入、品質試験といった複数の工程から成り立ちます。
本記事では、CAR-T細胞の作製法を、研究初心者の方にもわかりやすく解説します。
さらに、CAR-T細胞が抱える課題についてもご紹介します。
これらを理解することは、今後の研究方針を決めるためにもおすすめです。
CAR-T細胞とは
CAR-T細胞は、患者さん自身の免疫細胞「T細胞」を材料として作られ、遺伝子導入によってがん細胞に対する強い攻撃力を獲得した細胞です。
その能力に寄与するのが、「CAR(カー)」と呼ばれる人工的なセンサー構造です。
本項では、CAR-T細胞の構造と、がん細胞への攻撃メカニズムについて見ていきましょう。
CAR-T細胞の構造
CAR-T細胞は、表面に「CAR(Chimeric Antigen Receptor:キメラ抗原受容体)」構造が組み込まれています。
CARは、以下の3つの部分から主に構成されています。
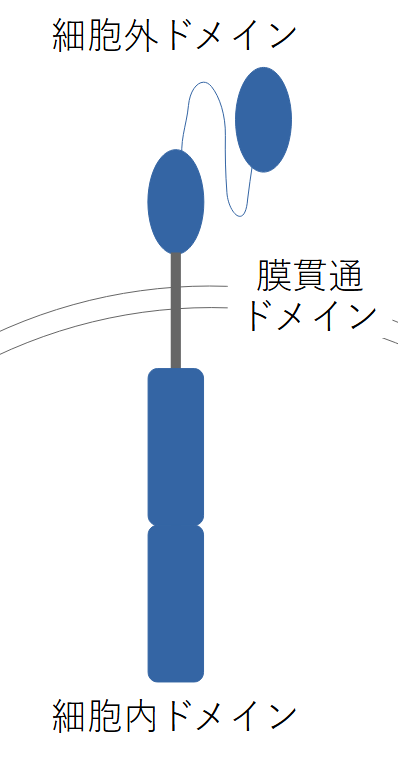
(1) 細胞外ドメイン(抗原認識部位)
がん細胞の表面にある特定の抗原を認識し、結合します。
一般的に利用されるのが、モノクローナル抗体の一部分(単鎖抗体:scFv)です。
(2) 膜貫通ドメイン
細胞外にある抗原認識部位と、細胞内にあるシグナル伝達部位とを繋ぎます。
CARが細胞膜から離れず機能するには、この部分が必要です。
(3) 細胞内ドメイン(シグナル伝達部位)
細胞外ドメインががん細胞と結合すると、細胞内ドメインにより、T細胞を活性化させるシグナルが伝えられます。
近年のCAR-T細胞では、基本的なシグナル部位(CD3ζ)に加えて、効果を上げるための共刺激シグナル部位(CD28または4-1BB)が追加されています。
CAR-T細胞の作用メカニズム
できあがったCAR-T細胞は、病院で患者さんの体内に戻され、がん細胞を攻撃します。
そのプロセスは、大きく分けて3段階です。

(1) 結合
血液中を流れるCAR-T細胞が、CARの細胞外ドメインを介して、がん細胞表面の抗原に結合します。
(2) 活性化
がん細胞との結合がスイッチとなり、CARの細胞内ドメインからシグナルが発せられ、CAR-T細胞が活性化されます。
(3) 攻撃
活性化したCAR-T細胞は、がん細胞を破壊する物質を放出します。
その代表が、「パーフォリン」と「グランザイム」です。
まず、パーフォリンががん細胞の細胞膜に穴を開けます。
開いた穴から、グランザイムが細胞内に侵入し、アポトーシス(細胞死)を誘導します。
CAR-T細胞の作製法:6つのステップ
CAR-T細胞は、特定の患者さんのために作られるオーダーメイド品です。
その作製は、以下6つの工程から成り立ちます。

リンパ球採取
患者さんの血液から、CAR-T細胞の材料となるT細胞を採取します。
「アフェレーシス」と呼ばれる方法が用いられ、T細胞を含む成分(リンパ球)を、専用の機器を使って集めます。
T細胞分離
採取されたリンパ球は、CAR-T細胞の製造施設へ輸送されます。
そこで最初に行われるのが、T細胞を選び出す作業です。
例えば、抗体を結合させた微小なビーズを用いて、T細胞を選択的に吸着します。
T細胞活性化
次工程である遺伝子導入の効率を高めるため、T細胞を活性化させます。
例として、抗体を結合させた微小なビーズを用いて、T細胞に刺激を与えます。
遺伝子導入
活性化したT細胞に、CARを発現する遺伝子を組み込みます。
遺伝子の運搬によく利用されるのが、「ウイルスベクター」です。
病原性を無くしたウイルス(主にレンチウイルスやレトロウイルス)にCAR遺伝子を搭載。
これをT細胞に感染させ、遺伝子を組み込むことで「CAR-T細胞」へと変化させます。
CAR-T細胞増殖
CAR-T細胞を培養し、治療に十分な数まで、数日かけて増やします。
品質管理試験
増殖させたCAR-T細胞は、患者さんに投与される前に厳格な品質管理試験を受けます。
これは、安全性と有効性を保証するための最終関門です。
試験項目は多岐にわたり、例えば以下の点がチェックされます。
・無菌試験、エンドトキシン試験:細菌や、細菌が持つ毒素で汚染されていないか
・生存率試験:細胞が十分に生きているか
・遺伝子導入コピー数試験:細胞に導入されたCAR遺伝子の数は適切か
全ての試験をクリアしたCAR-T細胞だけが、患者さんが待つ医療機関へ輸送されます。
CAR-T細胞に関する4つの課題
CAR-T細胞は血液がんの画期的な治療法として登場しましたが、さらなる普及に向けては課題があります。
本項では、以下4つについて解説します。
高額な費用
例えば、日本で承認されている「キムリア」の薬価は、1人3,000万円以上です。
理由は、患者さん本人の細胞を採取して製造するオーダーメイド品だからです。
先に述べた通りプロセスは複雑であり、専門的な設備や人員も必要となるため、莫大な製造コストがかかります。
長い治療期間
プロセスの複雑さは、治療期間の長期化も招きます。
患者さんから細胞を採取した後、CAR-T細胞が患者さんに投与されるまで、約5~6週間かかります。
投与後も、経過観察のため約1ヶ月入院するのが一般的です。
重篤になり得る副作用
特によく知られる副作用が、「サイトカイン放出症候群(CRS)」です。
CAR-T細胞ががん細胞を攻撃する際に、体内の免疫を制御する「サイトカイン」が過剰に放出され、強い炎症反応が起こります。
CRSは発熱や悪寒、筋肉痛といった症状から始まり、重症化すると血圧低下や呼吸困難に至る可能性もあるのです。
そのため医療機関では、重症化を早期発見する目的で、患者さんの状態を観察する体制を取ります。
一定の再発リスク
がんが再発する場合もあり、その原因はがん細胞側・CAR-T細胞側の両方にあると考えられています。
まず、がん細胞側の要因として挙げられるのが、「標的抗原の消失」です。
CAR-T細胞は、がん細胞の表面にある特定の抗原(例:CD19)を認識して攻撃します。
しかし、治療中に抗原の発現が低下する場合があり、攻撃できなくなってしまうのです。
一方、CAR-T細胞側では、「細胞の疲弊」が要因です。
CARを介した反応を繰り返すと、サイトカインの分泌や細胞傷害を起こせなくなってしまいます。
まとめ
CAR-T細胞の作製プロセスは、細胞の採取・分離、遺伝子導入、品質試験といった複数の工程から成り立ちます。
血液がんの画期的な治療法として登場した一方で、さらなる普及に向けては、まだ課題があります。
CAR-T細胞の作製法および課題を理解することは、今後の研究方針を決めるためにもおすすめです。


